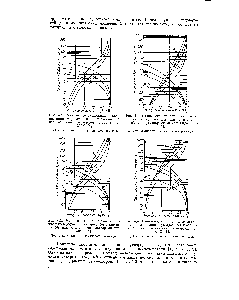
- Равновесное давление паров аммиака в воде
- Химические физические и тепловые свойства аммиака NH3 он же холодильный агент R 717
- Химические свойства аммиака
- Физические свойства аммиака
- Химический справочник Парциальные давления NH3 и H2O в мм рт ст над растворами аммиака
- Термодинамические свойства аммиака NH3 Удельный объем энтальпия энтропия в состоянии насыщения и перегретых паров аммиака
- Удельный объем
- Энтальпия и энтропия
- Свойства аммиака: плотность, теплоемкость, теплопроводность (NH3)
- Видео:
- Кипение и конденсация
Равновесное давление паров аммиака в воде
Аммиак является химическим соединением NH3. Он обладает различными свойствами в газообразном и жидком состояниях, а также при различных температурах и давлениях. В данном справочнике представлены термодинамические и теплофизические значения аммиака и воды.
В таблице указаны значения температуропроводности, удельного тепла, теплоемкости и энтальпии в различных состояниях: газообразном, жидком и насыщенного пара. Также в таблице представлены значения давления насыщенных паров аммиака и воды при различных температурах.
Знание данных термодинамических и теплофизических свойств аммиака и воды является необходимым для безопасной эксплуатации оборудования, работающего с этими веществами. Кроме того, знание значений давления насыщенных паров аммиака и воды важно для оценки опасности и способности этих веществ к образованию паров в различных условиях.
Химические физические и тепловые свойства аммиака NH3 он же холодильный агент R 717
Химические свойства аммиака
Аммиак является газообразной формой азота и водорода. Он может быть использован в различных химических реакциях и процессах, благодаря своей высокой реакционной способности. Парциальные давления аммиака в зависимости от его температуры могут быть указаны при его различных состояниях.
Физические свойства аммиака
При низких температурах аммиак может существовать в твердой или жидкой форме. В газообразном состоянии его химические и физические свойства зависят от температуры и давления.
Удельный объем аммиака в газе или жидком состоянии уменьшается при повышении его температуры и давления.
Тепловые свойства аммиака включают в себя энтальпию паров, теплопроводность и температуропроводность. Энтальпия паров аммиака зависит от его температуры и может быть измерена в кДж/кгс. Теплопроводность аммиака в газе и жидком состояниях указаны при разных температурах и выражены в Вт/(м·град).
Забудьте, частичное давление аммиака в насыщенном паре или воде и значения, связанные с теплопроводностью и насыщением, даны при указанных температурах и давлениях.
Химический справочник Парциальные давления NH3 и H2O в мм рт ст над растворами аммиака
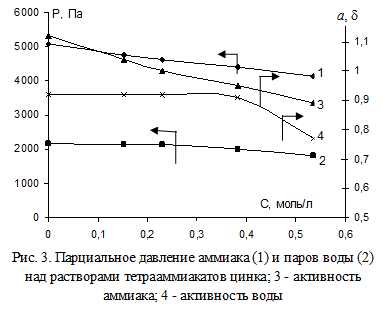
В данном разделе рассмотрим парциальные давления NH3 (аммиака) и H2O (воды) в зависимости от их концентрации в растворах аммиака. Парциальное давление представляет собой давление, которое каждый компонент газа оказывал бы, если бы он находился в газообразном состоянии на одинаковых условиях температуры и объема.
Различные растворы аммиака могут иметь различные парциальные давления NH3 и H2O при разных температурах и концентрациях. Например, при комнатной температуре и низкой концентрации аммиака, парциальное давление NH3 будет невысоким, в то время как парциальное давление H2O будет более значительным.
Важно отметить, что аммиак является опасным веществом, входящим в состав многих бытовых и промышленных продуктов. Он обладает высокой теплоемкостью (кДж/кг·°С), что может привести к быстрому нагреванию при попадании на кожу или вдыхании паров аммиака. Также удельный теплофизические свойства его растворов измеряются в кДж/кг·°С. Поэтому необходимо быть особенно осторожными при работе с аммиаком, соблюдая все меры предосторожности.
Другими важными термодинамическими свойствами аммиака являются теплопроводность (кВт/м·°С) и плотность (кг/м3) его пара при разных температурах и давлениях. Например, при повышении температуры и давления теплопроводность аммиака увеличивается, а его плотность уменьшается. Эти физические свойства аммиака являются важными при проектировании технических систем и при расчетах параметров сжиженного аммиака.
При снижении температуры ниже точки кипения аммиака (-33.34 °C) и увеличении давления, аммиак может быть насыщенным. Насыщенный аммиак обладает особыми физическими свойствами, такими как уменьшение скорости дыхания и снижение теплофизических параметров. Например, при немедленном воспламенении насыщенного аммиака наблюдается сгорание с ярким пламенем, а его энтропия и число теплофизических свойств существенно отличаются от значений в нормальных состояниях.
Итак, в химическом справочнике представлены парциальные давления NH3 и H2O в мм рт ст над растворами аммиака при различных концентрациях и температурах. Это важная информация для химиков, инженеров и других специалистов, работающих с аммиаком и его растворами, чтобы обеспечить безопасность и эффективность в процессах, где аммиак играет роль.
Термодинамические свойства аммиака NH3 Удельный объем энтальпия энтропия в состоянии насыщения и перегретых паров аммиака
Удельный объем
Удельный объем аммиака в газообразном состоянии зависит от температуры и давления. При нормальных условиях (температура 0°C, давление 1013.25 мм рт. ст.) удельный объем аммиака составляет примерно 0,699 куб. м/кг. При повышении температуры и снижении давления, удельный объем аммиака увеличивается.
Энтальпия и энтропия
Энтальпия аммиака в состоянии насыщения и перегретых паров также зависит от температуры и давления. Энтропия, с другой стороны, является мерой беспорядка и изменяется при различных термодинамических процессах.
Таблицы термодинамических свойств аммиака можно найти в различных физических и химических справочниках. Они приводят значения удельного объема, энтальпии и энтропии аммиака в зависимости от температуры и давления.
Например, при температуре 25°C и давлении 1 атм удельный объем аммиака составляет примерно 0,648 куб. м/кг, энтальпия — 662,2 кДж/кг, а энтропия — 4,70 кДж/(кг·К).
Важно отметить, что аммиак является опасным химическим веществом. При работе с аммиаком необходимо принимать меры предосторожности и следовать соответствующим инструкциям и правилам безопасности.