Процесс электролиза смеси соли и воды: образование реактивных веществ.
Электролиз соли с водой – это процесс электрохимического разложения растворов и расплавов солей водой с помощью электрического тока. При этом на электродах происходят окислительно-восстановительные реакции, в результате которых выделяется активный кислород на аноде и водород на катоде.
Входящие в состав солей их катионы и анионы проходят процессы окисления и восстановления соответственно при электролизе. Задание уравнений этих процессов является важным аспектом химической науки и промышленности.
Электролиз соли с водой может происходить и в растворе, и в виде расплава. При электролизе водного раствора соли, вода на катоде восстанавливается, а анодом окисляются анионы. Реакции на катоде обычно связаны с выделением водорода, а на аноде образуется кислород. Величина выделенного кислорода определяется по формуле фарадея. Кроме того, окислительными процессами могут быть описаны и реакции на анодах, содержащих никель, медь и другие кислородсодержащие электроды.
Электролиз соли с водой имеет большое значение для промышленности. В процессе электролиза получаются важные промышленные вещества, такие как хлор, щелочи и медь. Электролитами обычно служат растворы солей, содержащих эти вещества. Однако, некоторые аспекты электролиза соли с водой остаются малоизученными и требуют дальнейших исследований.
Электролиз солей
Теория электролиза основана на том, что при прохождении электрического тока через водный раствор или расплав солей, ионы катиона и аниона мигрируют к электродам, где они претерпевают химические превращения.
При электролизе соли в водном растворе, на катоде обычно выделяется водород, а на аноде — кислород или другие активные вещества, такие как хлор. Нерастворимый осадок может образоваться на электроде или находится в растворе.
Однако, при электролизе соли в расплавленном состоянии, металлы могут быть выделены на катоде. Это основано на разности потенциалов меди анода и анодом электролизера, установите для никеля. В результате такого электролиза можно получить различные металлы.
Электролиз солей имеет множество аспектов, и его процессы могут быть рассмотрены с точки зрения электрохимического уравнения, степени ионизации солей, реакции катионов и анионов и других химических свойств соли.
Суммарное электрическое потенциал соли после электролиза будет равно сумме потенциалов катода и анода, учитывая степень ионизации ионов соли. Таким образом, в зависимости от вида соли, процесс электролиза может давать различные результаты.
Важно заметить, что электролиз солей может происходить как в водном растворе, так и в расплавленном состоянии солей. Каждый случай имеет свои особенности и требует специального подхода для достижения желаемого результата.
Электролизер
В процессе электролиза, на аноде образуются анионы, которые движутся к катоду, а на катоде – катионы, которые перемещаются к аноду. Катод содержит малоактивного металла или металлов, а анод может быть изготовлен из активного металла или материала, устойчивого к действию электролита.
Уравнение электролиза водного раствора солей содержит соотношение между количеством веществ, растворимых в растворе, и суммарными количествами восстановления на катоде и окисления на аноде. Растворы солей могут быть как кислотные, так и щелочные, в зависимости от содержащихся в них ионов.
Пользуясь электролизером в промышленности, можно восстанавливать вещества, имеющие большую важность для производства. Катод раствора представляет собой металлическую пластину или сетку и является отрицательным электродом. Анод представляет собой положительный электрод, обычно изготовленный из материала, устойчивого к действию электролита, например, платины.
Теперь, когда мы знаем, что электролизер состоит из катода и анода, а также знаем процесс электролиза, можно установить, что при заданных значениях напряжений и концентрации растворов солей, образующиеся на катоде будут атомы водорода, а на аноде – кислород.
Количественные характеристики процесса электролиза водного раствора солей зависят от степени растворимости вещества, а также от количества проходящего тока. Величина восстановления на катоде и окисления на аноде может быть около 2 по порядку величины.
Электролиз расплава NaCl
При электролизе расплава NaCl (хлорида натрия) водного раствора происходит разложение вещества на аноде и катоде. В процессе прохождения электрического тока через раствор, на аноде происходит окисление хлорида кислородом:
— 2Cl⁻ -> Cl₂ + 2е⁻.
На катоде происходит восстановление воды водородом:
— 2Н₂О + 2е⁻ -> Н₂ + 2ОН⁻.
В результате электролиза на аноде образуется газовый хлор, а на катоде водород. При этом окисление и восстановление происходят одновременно, в соответствии с законом Фарадея. Электролизер, в котором происходит процесс разложения соли под действием электрического тока, представляет собой два электрода: анод и катод.
На аноде происходит окисление хлорида, ионные Cl⁻ вещества переходят в элементарный газ хлор, анод при этом является положительно заряженным. На катоде же происходит восстановление воды — анод отрицательно заряжен.
Рассмотрим сам процесс электролиза расплава NaCl на конкретном примере. Если установите справедливым работу электролизера, вы сможете наблюдать следующую картину: на аноде образуется газовый хлор, а на катоде происходит восстановление воды водородом. Таким образом, процессы окисления и восстановления прошедшего на электродах восстановления имеют место основе реакций по закону Фарадея.
Водород и хлор образуются на катоде и аноде соответственно:
- На катоде восстанавливается водородный катод — 2Н₂О + 2е‾ -> Н₂ + 2ОН‾.
- На аноде окисляются хлоридные ионы — 2Cl‾ -> Cl₂ + 2е‾.
Таким образом, анод является электродом, на котором происходит окисление, а катод — электрод восстановления.
Вещества находятся во взаимодействии и претерпевают различные процессы, в зависимости от их потенциала окисления или восстановления. Ионы Na⁺ и Cl⁻ растворяются в воде и движутся по направлению к электродам в электролизере, обеспечивая суммарное движение электронов и заряженных частиц. В результате вещества, находящиеся в водном растворе, подвергаются окислительно-восстановительным реакциям.
Электролиз водного раствора NaCl
При электролизе, ионы движутся вокруг своих электродов в растворителе. На аноде, положительная электрод, происходит окисление хлоридных ионов (Cl-) с образованием молекул хлора (Cl2) и освобождением электронов:
2Cl- → Cl2 + 2e-
На катоде, отрицательном электроде, происходит восстановление ионов воды (H+) с образованием молекул водорода (H2) и восстановлением электронов:
2H+ + 2e- → H2
Теперь мы можем рассмотреть прохождение процесса электролиза водного раствора NaCl более подробно. По закону ионного перемещения, положительные ионы (катионы) движутся к отрицательному электроду (катоду), а отрицательные ионы (анионы) движутся к положительному электроду (аноду).
При прохождении электрического тока через раствор NaCl водного раствора, на аноде образуется газ хлор (Cl2) и раствор становится более щелочным из-за образования гидроксид-ионов (OH-), которые образуются при взаимодействии хлоридных и гидроксидных ионов:
2Cl- — 2e- → Cl2
2H2O + 2e- — 2OH- + H2↑
На катоде образуется водород (H2) и раствор становится более кислотным из-за образования ионов водорода (H+), которые образуются при реакции восстановления воды:
2H+ + 2e- → H2
Электролиз водного раствора NaCl может быть проведен в виде расплава. В этом случае раствор NaCl расплавляется и процессы электролиза происходят в расплаве. Катодом может быть металл, например, медь, на котором происходит восстановление ионов натрия в металлический натрий (Na), а анодом может быть сам NaCl.
Таким образом, электролиз водного раствора NaCl представляет собой важный процесс в химии и позволяет получать различные вещества, такие как хлор, натрий, гидроксиды, кислоты и щелочи, а также использовать его в процессах восстановления, окисления и других химических реакциях. Электролиз водного раствора NaCl имеет широкое применение в промышленности и научных исследованиях.
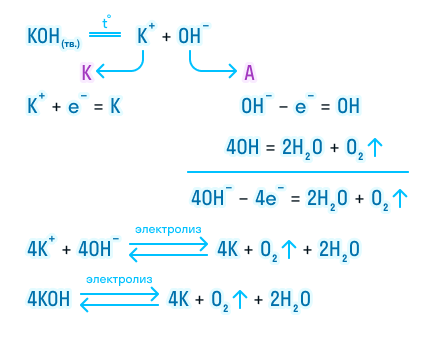
Процесс на катоде
На катоде электролизера, применяемого для электролиза соли с водой, происходит процесс восстановления. В данном случае, на катоде металлического электрода, из раствора нерастворимого вещества в форме меди образуются ионы меди. Это происходит по следующей реакции: Cu2+(aq) + 2e- -> Cu(s).
В процессе электролиза соли с водой в растворе также присутствуют ионы гидроксида, которые формируются в результате реакции 2H2O(l) -> 2H2(g) + O2(g) + 4e-. Ионы гидроксида (OH-) заряжены отрицательно и притягиваются к катоду, где претерпевают окисление, образуя молекулярный кислород (O2) и воду (H2O) согласно реакции 4OH-(aq) -> 2H2O(l) + O2(g) + 4e-.
Таким образом, на катоде электролизера в процессе электролиза соли с водой образуется медь, а также выделяется водород и кислород. Процессы на катоде и аноде электролизера тесно связаны, и только благодаря им происходит разложение соли водой на составляющие вещества.
Данный процесс на катоде имеет широкое применение в промышленности и химии. Например, медь, полученная на катоде электролиза соли меди, может использоваться для различных целей, включая производство электроники или проводов. Также электролиз соли с водой на катоде применяется для подготовки нерастворимых осадков в виде металлов, которые могут использоваться в количественных аналитических методах. Для проведения электролиза солей с водой и получения осадков используют специальные устройства — электролизеры или щелочные камеры.
Процесс на аноде
На аноде электролизируемого раствора содержатся вещества, расплавы или водные растворы солей или щелочей металлов. В процессе электролиза на аноде происходят реакции окисления этих веществ.
Например, при электролизе хлорида натрия (NaCl) на аноде происходит реакция:
2Cl— → Cl2(газ) + 2e—
Анодом может быть любой проводящий материал, способный не растворяться в растворе или расплаве. В случае электролиза водного раствора медного(II)сульфата (CuSO4) на аноде медь будет восстанавливаться по закону Фарадея:
Cu2+ + 2e— → Cu
Таким образом, на аноде электролизера в процессе электролиза будут выделяться газы или происходить нерастворимые осадки в виде воздуха или нерастворимых солей металлов.
Электролиз солей – количественные аспекты
На аноде происходит окисление ионы хлора (Cl-) с образованием газообразного хлора (Cl2). На катоде происходит восстановление ионы натрия (Na+) с образованием металлического натрия (Na).
Для проведения электролиза требуется электролизер, установите на него постоянное напряжение. На аноде происходит окисление, поэтому над анодом образуется положительный потенциал, а на катоде происходит восстановления, поэтому над катодом образуется отрицательный потенциал.
Теперь давайте обсудим, как количественно определить, сколько вещества будет произведено при электролизе. Для этого используется закон Фарадея, который устанавливает зависимость количества продуктов электролиза от количества электричества.
Итак, в ходе электролиза количество прошедших электрических зарядов, измеряется в кулонах, связано с количеством электронов. В электролизе заряд переносится ионами, поэтому при электролизе в качестве ионов, в нашем случае, действуют ионы Na+ и Cl-.
Следующие потенциалы степени окисления на аноде и восстановления на катоде известны из таблицы стандартных потенциалов:
- На аноде: хлор (Cl2) — 1,36 В;
- На катоде: натрий (Na) — 2,71 В.
Из этого следует, что процесс окисления (на аноде) будет более активным, чем процесс восстановления (на катоде). Поэтому на аноде происходит электролиз малоактивного и сильной окисляющей способности взаимодействия, в то время как на катоде электролиз происходит низкоактивного металла с высокой способностью к окислению.
Электролиз соли NaCl в растворе воды можно рассматривать как электролиз раствора соли и электролиз воды. В электролизе раствора соли на аноде происходит образование хлора, а на катоде – натрия.
При электролизе воды на аноде образуется кислород (О2), а на катоде – водород (H2). Естественно, электролиз воды имеет более низкий потенциал, чем электролиз раствора соли NaCl.
В результате электролиза раствора соли в воде образуется хлор (Cl2) на аноде и водород (H2) на катоде. Между анодом и катодом происходят параллельно два процесса: электролиз соли NaCl в растворе и электролиз воды.
При этом образующиеся газы смешиваются и образуют хлорводород (HCl) – гидрохлоридную кислоту.
Исключение составляют щелочи металлов группы 1 (натрий, калий), так как в этих случаях электролизом раствора щелочи образуются только ионы натрия (Na+) или калия (K+).
Теперь рассмотрим процесс электролиза натрия (Na) в растворе воды. При электролизе вода окисляется и водород выделяется на аноде, а натрий окисляется на катоде. Но в данном случае натрий реагирует с водой, образуя гидроксид натрия (NaOH) и выделяется водород:
2Na + 2H2O → 2NaOH + H2↑
Таким образом, при электролизе соли NaCl в растворе воды происходит окисление хлора на аноде и восстановление натрия на катоде, при этом образуются хлор и натрий.
Изучение электролиза солей и электролиза воды является важной темой в курсе химии для подготовки к экзаменам ЕГЭ и ГИА. Успех в освоении этой темы позволит лучше понять механизмы и законы электролиза, а также развить навыки количественного анализа.
- Электролиз солей является электрохимическим процессом, при котором происходит разложение солей на ионы
- При электролизе соли NaCl в растворе воды на аноде образуется хлор, а на катоде — натрий
- При проведении электролиза важны количественные аспекты, определяемые законом Фарадея
- Электролиз солей и электролиз воды имеют различные потенциалы и процессы
- Изучение электролиза солей и электролиза воды является важным для подготовки к экзаменам ЕГЭ и ГИА
Темы, связанные с электролизом солей, также имеют практическое применение в различных областях науки и технологий, таких как производство металлов и электролитическая очистка воды.
Видео:
Электролиз
Электролиз by GetAClass — Физика в опытах и экспериментах 83,123 views 4 years ago 3 minutes, 36 seconds