- Способы снижения концентрации раствора с помощью воды
- Расчеты при приготовлении водных растворов
- Пример расчета концентрации
- Расчеты при высокой концентрации раствора
- Формулы для пересчета концентраций растворов
- 1. Молекулярный пересчет
- 2. Разбавление раствора водой
- Видео:
- Лабораторная работа "Приготовление растворов и определение концентрации кондуктометрическим методом"
Способы снижения концентрации раствора с помощью воды
Следует отметить, что уменьшение концентрации раствора водой имеет свои особенности и требует аккуратного подхода. Результаты анализа показывают, что меньше вещества растворяется в воде при высокой концентрации раствора. Однако, существуют способы, с помощью которых можно достичь нужной концентрации.
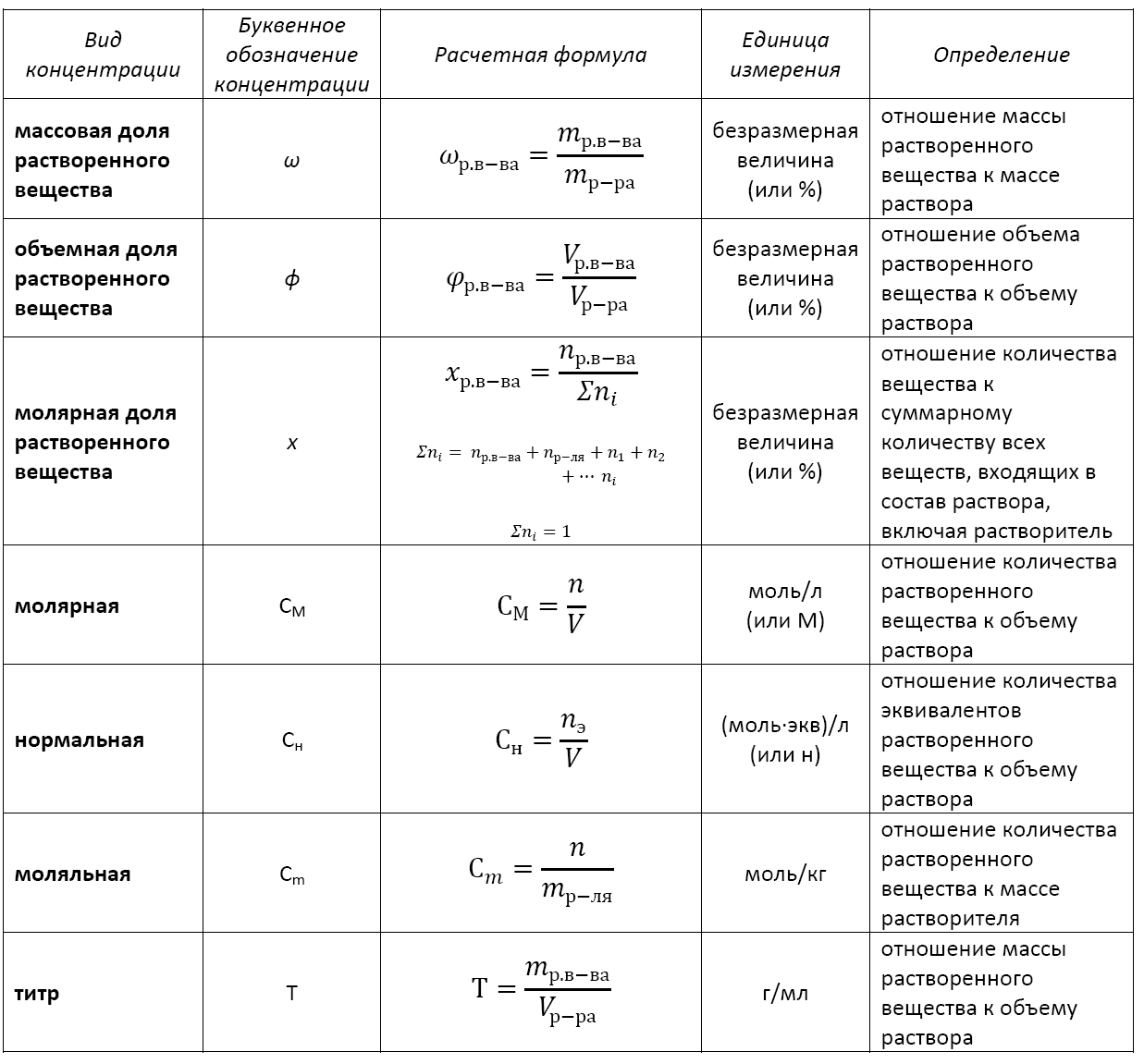
Для начала, рассмотрим методы расчета концентрации раствора. В случае использования атомных меток, можно пользоваться формулой: концентрация = (количество атомов данного элемента в растворе) / (количество молекул в молекулярном весе данного элемента) * 100%. Например, для натрия с атомной массой 22.99 г/моль, значение подсчитывается следующим образом: концентрация = (масса натрия в г) / (22.99 г/моль) * 100%.
Если у нас есть раствор, который нужно разбавить до нужной концентрации, то следует пользоваться формулой: V1 = (V2 * C2) / C1, где V1 — объем начального раствора, V2 — объем конечного раствора, C1 — начальная концентрация, C2 — конечная концентрация. Не забывайте про точность измерения объема и использование наименьшей колбы для приготовления раствора.
Расчеты при приготовлении водных растворов
При приготовлении водных растворов необходимо проводить различные расчеты, чтобы получить желаемую концентрацию раствора. Для этого следует использовать соответствующие формулы и учитывать подсчитанные значения. Рассмотрим пример расчета концентрации раствора на конкретных числах.
Пример расчета концентрации
Пусть необходимо приготовить 100 мл раствора 0,1 M NaCl (хлорида натрия) из 0,5 M NaCl. Какой объем исходного раствора следует взять?
Для решения этой задачи можно воспользоваться формулой:
М1V1 = M2V2
где:
- М1 и V1 — концентрация и объем исходного раствора соответственно;
- М2 и V2 — концентрация и объем желаемого раствора соответственно.
По условиям задачи, мы знаем, что М1 = 0,5 M (концентрация исходного раствора), V2 = 100 мл (объем желаемого раствора).
Чтобы найти V1, перепишем формулу:
V1 = (M2 * V2) / М1 = (0,1 * 100) / 0,5 = 20 мл
Таким образом, необходимо взять 20 мл исходного раствора для приготовления 100 мл раствора с концентрацией 0,1 M NaCl.
Расчеты при высокой концентрации раствора
При высокой концентрации раствора, например, выше 1 M, возникает необходимость использовать более точные расчеты.
Для растворов с высокой концентрацией применяют разбавление или графические методы расчетов. В случае разбавления раствора с известной концентрацией до желаемой концентрации можно воспользоваться формулой:
M1V1 + M1’V1′ = M2V2
где:
- M1 и V1 — концентрация и объем исходного раствора;
- M1′ и V1′ — концентрация и объем разбавляющей среды (например, вода);
- M2 и V2 — концентрация и объем желаемого раствора.
Например, если необходимо подсчитать количественные результаты при разбавлении 25-ного раствора непротивляемого вещества до более низкой концентрации, следует учесть, что при этом сохраняется масса вещества, но уменьшается его молекулярная нормальность или колориметрический показатель. Для подсчета массы, которую следует взять, можно воспользоваться формулой:
масса для результатов = масса разбавляемого раствора * М1 * (разбавленного раствора / начального раствора)
Например, если изначальный раствор имеет концентрацию 1 M NaCl и вам необходимо приготовить 500 мл раствора с концентрацией 0,5 M NaCl, то формула будет выглядеть следующим образом:
масса для результатов = масса начального раствора * (0,5 M / 1 M) = масса начального раствора * 0,5
Таким образом, при расчетах для высокой концентрации раствора следует использовать соответствующие формулы и методы, учитывая точные значения объема, концентрации и молекулярной нормальности вещества.
Формулы для пересчета концентраций растворов
При приготовлении растворов, часто возникает необходимость в пересчете концентрации раствора. Это может понадобиться, например, при разбавлении концентрированных растворов с использованием воды.
Разбавление раствора представляет собой процесс смешивания заданного объема раствора с определенным объемом воды или другого растворителя, дабы получить раствор нужной концентрации.
Точных формул для пересчета концентраций растворов не существует, так как они зависят от многих факторов. Однако, существует несколько правил, которые можно использовать для ориентировочного расчета.
1. Молекулярный пересчет
Для примера возьмем 20-ный раствор соли (расчет производится для этого примера).
- Взять мерную колбу и добавить в нее объем разбавляемого раствора соли.
- С помощью воронки добавить к заданному объему раствора 20-ный объем воды.
- Полученное количество раствора переливаем в другую мерную колбу.
- Добавляем соответствующий объем воды до общего объема, заданного в рецепте.
2. Разбавление раствора водой
В этом случае вычисляем количество разбавляемой воды следующим образом:
- Подсчитываем объем заданного раствора, который мы хотим получить.
- Вычитаем объем разбавленного раствора из исходного объема.
- Результат умножаем на плотность разбавленного раствора.
- Полученное число делим на разность плотности чистой воды и плотности разбавленного раствора.
Имейте в виду, что эти формулы являются упрощенными и могут давать приближенные результаты. В некоторых случаях могут быть необходимы более точные методы расчета.
Важно помнить, что при разбавлении растворов солью или другими твердыми веществами, их концентрация становится меньше, а объем воды становится больше. Поэтому следует быть внимательными при проведении расчетов.
Видео:
Лабораторная работа "Приготовление растворов и определение концентрации кондуктометрическим методом"
Лабораторная работа "Приготовление растворов и определение концентрации кондуктометрическим методом" by Olga Medvedeva 1,620 views 1 year ago 9 minutes, 43 seconds