Вода с гелием и гидрокарбонатами обладает восстановительными свойствами.
Водород и его соединения обладают уникальными восстановительными свойствами, которые широко применяются в химической промышленности и научных исследованиях. Вода, водородные гидриды, гидрокарбонаты, кислоты и другие соединения водорода могут быть использованы как сильные восстановители в химических реакциях.
Водород реагирует с оксидами и образует соединения, в которых он представлен в степени окисления -1. Например, при взаимодействии сульфида натрия (Na2S) с водородом, образуется сероводород (H2S). Кроме того, водород активно взаимодействует с металлами, образуя гидриды, а с неметаллами — гидриды и гидрокарбонаты.
Вода сокращает окислительные свойства многих веществ, включая кислород и кислоты. Водородные гидрокарбонаты, такие как сода (NaHCO3) и аммиак (NH3), действуют как слабые восстановители. Например, аммиак реагирует с оксидной кислотой, образуя соединение кислорода с водородом — воду.
Водород
Водород обладает множеством уникальных свойств. Он является твердым веществом при очень низких температурах, однако превращается в газ при комнатной температуре и нормальном атмосферном давлении. Твердый водород образует кристаллический решетку и имеет низкую плотность.
Водород обладает способностью легко взаимодействовать с другими веществами. Он окисляется водой и азотной кислотой, а также реагирует с хлором, серным гидроксидом и другими химическими веществами. При взаимодействии с кислородом водород образует воду. Кроме того, водородные соединения легко гидролизуются, образуя кислоты и соли.
Водород может быть получен различными способами. Один из способов — это получение водорода путем электролиза воды или паровой воды. Вещества, содержащие водород в своей составе, такие как вода, гидрокарбонаты и гидроксиды, могут быть разлагаются при нагревании или путем воздействия электрического тока.
Водород также может быть получен путем реакции метала с кислотой. Например, взаимодействие металла натрия с водой или серной кислотой приводит к образованию водорода. Еще один способ получения водорода — это реакция гидрида с кислотой.
Водородные соединения могут быть использованы в различных областях науки и промышленности. Например, силан и сероводород используются в электронной промышленности для получения чистого кремния и в других химических процессах.
Водород обладает также восстановительными свойствами. Например, водород может быть использован для восстановления окисленных металлов, таких как медь или железо, образуя воду и оказывая степень окисления -1. Восстановительные свойства водорода широко используются в химической промышленности.
Таким образом, водород — это очень важный и универсальный элемент, который обладает множеством уникальных свойств и может быть получен различными способами. Его восстановительные свойства и способность взаимодействовать с другими химическими веществами делают его неотъемлемой частью химии и промышленности.
Водород химия водорода и его соединений
Водород обладает уникальными химическими свойствами. Он образует множество соединений с другими элементами, такими как кислород, углерод, фтор и многими другими. Водород обычно вступает в реакцию с другими элементами как водородные ионы (H+) или водородные атомы (H).
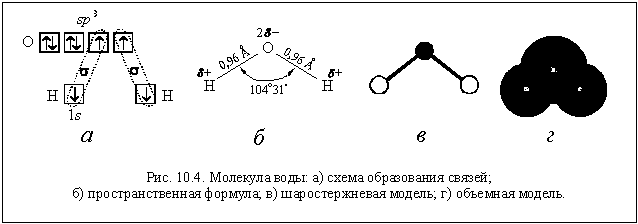
Вода (H2O) является наиболее известным соединением водорода. Она образуется путем соединения двух атомов водорода с одним атомом кислорода. Вода имеет множество физических и химических свойств, которые делают ее непременным компонентом для многих процессов и жизненно важна для всех организмов на Земле.
Восстановительные свойства водорода часто используются в различных промышленных и лабораторных процессах. Водород легко восстанавливает окисления и соединяется с рядом веществ, включая оксиды многих металлов и некоторые кислоты. Например, водородная плазма, полученная с использованием высоких напряжений и радиоволн в сочетании с водой, может разлагаться на молекулы водорода и кислорода.
Водородные соединения имеют различные свойства взаимодействия с различными элементами. Например, водород образует гидроксиды со многими щелочами, образуя основные растворы. Также известны лабораторный синтез водородсодержащих минеральных соединений, таких как гидроксиды натрия (NaOH), гидроксиды калия (KOH) и гидроксиды группы щелочноземельных металлов.
Фосфиды водорода — типичные восстанавливающие вещества, которые используются в химических процессах восстановления. Например, фосфид натрия (NaH2P) может взаимодействовать с оксидами различных металлов, восстанавливая их до металлов. Фосфид водорода также является основным компонентом в процессе синтеза медного фосфида (Cu3P).
У водорода есть множество применений в различных областях. Например, он используется в качестве топлива для различных видов транспорта, таких как автомобили и ракеты. Водород также используется в процессе производства аммиака, удобрений и других химических соединений. Кроме того, он активно применяется в лабораториях и научных исследованиях, включая видеоопыты и эксперименты с разлаганием водородом щелочных металлов и металлов группы платины.
Водород
Один из способов получения водорода — реакция металла с кислотой в водном растворе. Например, при взаимодействии цинка и серной кислоты образуется водород:
- Цинк + серная кислота → водород + цинксульфат
Водород также может быть получен путем разложения воды электрическим током. Это называется электролизом воды и является одним из основных способов получения водорода в промышленности.
Водород обладает высокой электроотрицательностью и легко окисляется многими неметаллами. В реакциях с некоторыми химическими соединениями, водород может быть использован в качестве восстановителя.
Например, сероводород (H2S) разлагается на серу и водород при воздействии электрических напряжений:
- 2H2S → 2H2 + S2
Водород также реагирует с оксидами некоторых металлов, восстанавливая их до металлического состояния. Например, с оксидом кальция (CaO) водород образует металлический кальций:
- CaO + H2 → Ca + H2O
Водород обладает свойствами, позволяющими его использовать в различных физических и химических процессах. Например, при нагревании водорода в присутствии кислорода он сгорает, образуя воду:
- 2H2 + O2 → 2H2O
Также, водород обладает легкими летучими свойствами, что делает его полезным в качестве среды для перемещения легких некоторых веществ.
Водород используется во многих областях, включая производство аммиака в лаборатории, получение гелия и водорода, а также слабые окисляющие свойства в некоторых химических реакциях.
Применение водорода
Под воздействием водорода происходит реакция восстановления оксидных соединений, например, оксидов металлов. Водород реагирует с оксидами металлов, образуя воду в результате химической реакции. Например, водородная пероксидная вода, после воздействия водорода, превращается в простую воду.
Водород также может реагировать с другими веществами, образуя соединения. Например, с водным раствором сероводорода вода взаимодействует с водородом, образуя серу и сульфид водорода.
Водород является важным компонентом в процессах гидрогенизации, которые применяются в производстве различных химических соединений. Например, он используется в получении аммиака, который в свою очередь используется в производстве удобрений и других химических соединений. Водород также используется в процессе получения металлов, таких как алюминий и медь.
Водород также широко используется в электролизе воды. В результате этого процесса водород и кислород из воды выделяются в виде газов. Оксиды металлов также могут быть восстановлены водородом. Например, водород взаимодействует с оксидом меди, образуя медь и воду.
Водород также находит применение в процессе гидролиза нитратов, фосфатов и других соединений. В результате взаимодействия водорода с нитратом меди, образуется медь и вода. Водород также может быть использован для восстановления неметаллов, например, фосфида водорода при реакции с оксидом фосфора.
Водородные соединения, такие как аммиак и аммиакаты, являются важными компонентами в производстве удобрений, кислот и других химических соединений. Водород также используется в производстве серной кислоты, получения хлора и других бинарных соединений.
Таким образом, водород проявляет свои восстановительные свойства в различных химических реакциях, что делает его важным компонентом в различных производственных процессах и применениях.
Водородные соединения металлов
Водород образует соединения с различными металлами, такие как натрий (Na) и калий (K), образуя соответствующие гидриды, такие как NaH (2Na + H2) и KH, которые могут быть использованы в различных химических реакциях.
Водородные гидриды металлов имеют типичные свойства водорода и металла в одном соединении. Они являются летучими, имеют слабые восстановительные свойства и могут гидролизоваться в воде, взаимодействовать с кислотами, образуя вещества типа NaH + H2O = NaOH + H2 и поглощать воздух из-за окисления водорода в окислители, например NaH + O2 = Na2O + H2O.
Содержащие гидриды металлов водородные соединения также реагируют с неметаллами. Например, натрий гидрид (NaH) может реагировать с серой, образуя сероводород (H2S): NaH + S = Na2S + H2. Кроме того, с рядом галогенов можно получить хлорид металла и гидрид водорода: NaH + Cl2 = NaCl + HCl.
Водородные соединения металлов могут также образовываться в реакциях солей с кислотами. Например, алюминий гидролизуется в воде, образуя алюминиевый гидроксид (Al(OH)3) и высвобождая водородный газ (H2): 2Al + 6H2O = 2Al(OH)3 + 3H2. Также металлический натрий реагирует с азотной кислотой (HNO3), образуя гидроксид натрия (NaOH), оксид азота (NO) и высвобождая водородный газ: 2Na + 2HNO3 = 2NaNO3 + H2O + NO + H2.
Водородные соединения металлов имеют широкое применение, как в химии, так и в физических свойствах. Например, гидрид кремния (SiH4) используется при производстве кристаллогидратов и разлагается при нагревании: SiH4 = Si + 2H2. Азотид кремния (SN) может быть использован как источник азота при производстве минеральных удобрений. Гидриды алюминия (AlH3) и железа (FeH2) являются крепкими восстановителями и служат в качестве начальных соединений при производстве других веществ, таких как купорос (FeSO4) и оксид хрома (CrO3).
Летучие водородные соединения
Летучие водородные соединения образуются при взаимодействии гидрокарбонатов и щелочей с кислотами или оксидами неметаллов. Некоторые из них могут быть сильными восстановителями, такие, например, как водородная серная кислота (H2SO4) и соляная кислота (HCl).
Кислоты обладают способностью образовывать водородные соединения при своем взаимодействии с активными металлами, такими как цинк (Zn), алюминий (Al) или медь (Cu). В результате реакции образуется гидроксид металла и водород. Некоторые кислоты, такие как серная кислота, обладают сильными восстановительными свойствами, способными разлагать оксиды и гидроксиды многих металлов и образовывать соединения с водородом.
Летучие водородные соединения также образуются при действии кислот на некоторые соли и основы. Например, при взаимодействии аммиака (NH3) с соляной кислотой образуется хлорид аммония (NH4Cl) и водород. Салициловая кислота (C6H6O3) реагирует с медным оксидом (CuO) и образует медный гидроксид (Cu(OH)2) и водород. Эти реакции часто происходят под действием катализатора, такого как палладий (Pd) или платина (Pt).
Некоторые летучие водородные соединения имеют самовоспламеняющиеся свойства при контакте с воздухом. Например, водородные соединения меди (CuH) и цинка (ZnH2) взрывчаты и воспламеняются при взаимодействии с кислородом воздуха.
Летучие водородные соединения также широко применяются в химической промышленности. Образование этих соединений может использоваться для получения водорода, а также в химических реакциях для восстановления оксидов металлов или разложения сложных органических соединений. Паровая кислота, аммиак и другие летучие водородные соединения являются важными промышленными химикатами.
| Вещество | Формула | Свойства |
|---|---|---|
| Водородная серная кислота | H2SO4 | Сильный восстановитель, разлагает оксиды и гидроксиды многих металлов |
| Соляная кислота | HCl | Сильный восстановитель, обладает высокой реактивностью |
| Аммиак | NH3 | Имеет щелочные свойства, образует летучие соединения с кислотами |
| Водород | H | Самый летучий элемент, образует летучие составы со многими веществами |
Видео:
ПРО ВОДОРОД И ГЕЛИЙ — ПОДРОБНО С КАРТИНКАМИ
ПРО ВОДОРОД И ГЕЛИЙ — ПОДРОБНО С КАРТИНКАМИ автор: ТЕМЫ ДЛЯ МЫШЛЕНИЯ 2 559 переглядів 6 років тому 10 хвилин і 33 секунди